domingo, 15 de octubre de 2017
1.1. Soluciones
Definición.
Se habla de una disolución acuosa
siempre que el disolvente (o el disolvente mayoritario, en el caso de una
mezcla de disolventes) es agua. El agua como disolvente es muy polar y forma
puentes de hidrógeno muy fuertes. Las disoluciones acuosas tienen una gran
importancia en la biología, desde los laboratorios de ciencia básica hasta la
química de la vida, pasando por la química industrial. Por la vasta cantidad y
variedad de sustancias que son solubles en agua, esta se denomina a veces
disolvente del milenio. (Lopez, 2011)
Forma
de preparación y propiedades de las porcentuales.
En la preparación de soluciones son
problemas los cuales se deben de resolver con una mayor frecuencia en el
laboratorio, se encuentra constituido por el acondicionamiento de la total
concentración en cuanto a soluciones de acuerdo a las necesidades específicas
de diferentes usos. La forma en la que se realiza es que se prepara disolviendo
una cantidad de soluto en un determinado volumen de disolvente, seguido de eso
se realiza previamente antes de estar en laboratorio.
Las composiciones porcentuales son: - % peso; se define como el peso del componente entre el peso de la solución por 100, - % mol; es el número de moles de cada uno de los componentes entre el número total de moles de solución por 100. Esta primera fórmula se utiliza cuando la masa del soluto, solvente o solución se expresa en gramos, el peso del soluto (masa) se divide entre el peso de la solución (peso sobre peso), el resultado parcial se multiplica por cien y de esta manera obtener el resultado final, el que indica el peso del soluto por cada cien unidades de peso de la solución.
Molares (M): expresa la concentración en
moles de soluto disueltos en un litro de solución. (Laawwr, 2012)
M= moles
de soluto
1 L de disolución
Como fórmula: M = n/V, M = M: Molaridad, N: Número de moles de
soluto, V: Volumen de solución expresado en litros.
Molales (m): expresa la concentración en
moles de soluto contenidos en un kilogramo solvente. (Laawwr, 2012)
M= moles de soluto
1 kg de disolvente
Como fórmula: m = n/kgs solvente m = Molalidad. N: Número de moles
de soluto por Kg = 1000 gramos de solvente o 1 kg de solvente.
Normales (N): concentración
de una solución en equivalentes- gramo de soluto por litro de solución. El
equivalente gramo es la cantidad de sustancia que reacciona de acuerdo con
1,008g de hidrógeno. El equivalente gramo depende si esta corresponde a un
ácido, un hidróxido (base) o una sal. Como fórmula: N = n eq/V, N = Normalidad,
n eq. : Número de equivalentes del soluto, V: Volumen de la solución en litros.
Osmolares (Osm): es el número
de osmoles de soluto contenidos en 1 litro de solución.
1
mol: cantidad de sustancia que contiene 6,02x1023 partículas.
°n de moles= masa
PM
1.2. Concepto
Osmolaridad
Es la concentración molecular de todas las partículas
osmóticamente activas contenidas en una solución. La osmolaridad se expresa en
osmoles (o en miliosmoles) por litro de solvente. La teoría fisicoquímica
indica que debe usarse osmolaridad, ya que los osmoles están disueltos solo en
el agua y no en todo el volumen de la solución: ésta tiene un cierto volumen
ocupado por los solutos. Sin embargo, debemos saber que hay veces en que la
diferencia entre una y otra manera de expresar y preparar una solución es
mínima y por lo tanto puede usarse mOsm/kg o mOsm/L indistintamente. Por el
contrario, en otros casos, la diferencia es grande y se hace obligatorio usar
mOsm/kg. (Nieto, 2012)
Hipotónicas
Es aquella que tiene menor
concentración de soluto en el medio externo en relación al medio cito
plasmático de la célula. Bebidas
hipotónicas: en estas bebidas la concentración de partículas por unidad de
volumen es inferior a la del plasma sanguíneo (menor presión osmótica). El agua es el mejor ejemplo de bebida
hipotónica, salvo las muy ricas en sales.
Tras ejercicios moderados que duran menos de una hora no es necesario un
aporte extra de electrolitos; es suficiente beber simplemente agua antes,
durante y después del ejercicio para conseguir una adecuada hidratación.
Isotónicas
Sustancias con unas
concentraciones soldad igual a la concentración interna de sólidos de la
célula, donde se aplique. Se encuentran
en bebidas con gran capacidad de rehidratación.
Incluyen en su composición bajas dosis de sodio, normalmente en forma de
cloruro de sodio o bicarbonato de sódico, azúcar o glucosa y habitualmente,
potasio y otros minerales. Ayuda a
retrasar la fatiga, evitar lesiones por calor (calambres y sincope), mejorar el
rendimiento y acelerar la recuperación.
Hipertónicas
Es aquella que tiene mayor
concentración de soluto que con el interior celular. Bebidas hipertónicos presentan una elevada
concentración de sustancias disueltas en el líquido, en concreto su
concentración es superior al 10%. Debido
a esta característica, el organismo libera agua para diluir este líquido
ingerido hasta que llegue a ser isotónico.
1.3. Unidades de medición
(osmoles, Moles, equivalentes, gramos) y conversión de
unidades.
Mol (mol) = Peso molecular (o atómico) expresado en
gramos
Minimol (mmol) = 10–3 mol
Equivalente gramo (Eq) = mol/valencia
Miliequivalente (mEq) = 10–3 Eq
Un ion monovalente (Na+, Cl–, K+, HCO–
1 Eq o 1 mEq es lo mismo que 1 mol o mmol.
1 ion divalente (Ca2+, Mg2+, SO4
1 mol es igual a 2 Eq y 1 mmol es igual a 2 mEq.
1.4. Equilibrio hídrico en el humano 1.5. Alteraciones del equilibrio hídrico
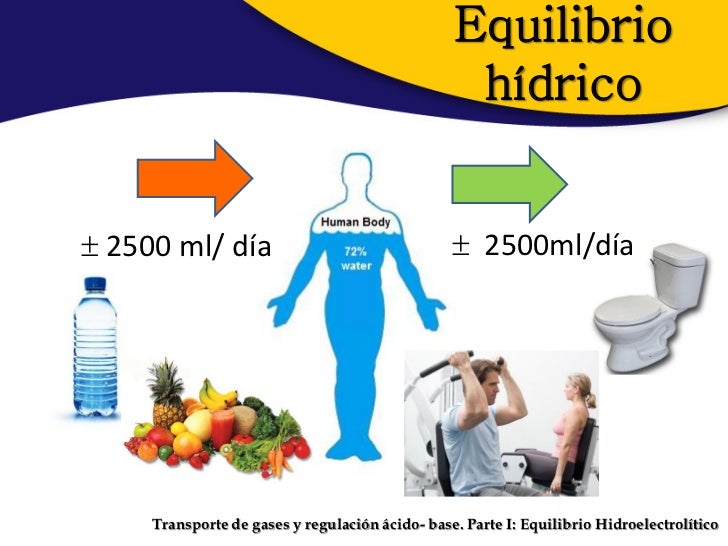
Equilibrio hídrico en el humano
Es cuando entran y salen las
mismas cantidades de líquido que se encuentran en el cuerpo humano. El agua se
considera el compuesto químico más abundante
tanto en la naturaleza como en el cuerpo humano, Constituye entre un 50
y un 70 % del peso corporal de los individuos adultos y entre un 70 y un 80 %
del peso corporal de los lactantes. El promedio del adulto sano pierde alrededor
de 2.6 L al día. Es muy importante en cuanto al mantenimiento del adecuado
equilibrio hídrico, es decir, en la diferencia neta entre el aporte y la
perdida de agua es realmente esencial para la salud, Ya que el cuerpo no tiene
la capacidad de almacenar agua, reponer el agua que pierde nuestro cuerpo, es a
diario. Los seres humanos tenemos que beber agua todos los días, ya que sin
agua no moriríamos en unos cuantos días. Diaria mente perdemos agua a través
de: (Desconocido)
·
el tracto
respiratorio (respiración)
·
el tracto
gastrointestinal (heces)
·
la piel
(transpiración y sudor)
·
los riñones
(excreción de orina)
Pérdida diaria de agua
Pérdida insensible de agua:
parte de las pérdidas de agua no puede regularse de modo preciso, la que se
pierde por evaporación de las vías respiratorias y difusión a partir de la
piel, lo que supone unos 700 ml al día, esta pérdida de agua es independiente
de la sudoración. Pérdida de agua por el sudor: es muy variable dependiendo de
la actividad física y de la temperatura ambiental. El volumen de sudor es de
unos 100 ml/día, pudiendo aumentar hasta 1-2l/h. Pérdida de agua por las heces:
se pierde normalmente una pequeña cantidad de agua unos 100 ml Pérdida de agua
por los riñones: el resto del agua perdida se excreta en la orina por los
riñones estas pérdidas son muy variables según el agua ingerida, pudiendo
oscilar entre 0,5 l al día, hasta 20 l. El medio más importante por el que el
organismo mantiene un equilibrio entre los ingresos y las pérdidas de agua y
electrolitos. (Desconocido, Fundacion para la
Formacion e Investigacion Sanitarias de la Region de Murcia)
Alteraciones del equilibrio hídrico: sobre hidratación y
deshidratación
En cuanto al cambio en la
osmolaridad plasmática solo sucede cuando la deshidratación alcanza la pérdida
entre el 1% y el 2% del peso corporal. en el día a día, estamos expuestos a
deshidratación leve y sin poder tener la sensación de sed, esta es una señal
tardía de la deshidratación. Es de suma importancia beber en intervalos
regulares a lo largo del día, en vez de hacerlo solo en momentos que se siente
sed. Así mismo en algunas personas, como en las personas mayores, la señal de
sed es un poco menos efectiva y es así como el riesgo de deshidratación va
aumentando.
Hidratación:
·
Beber en cantidad
suficiente para poder recuperar el agua perdida.
·
Los procesos metabólicos
de nuestro organismo producen alrededor de 250 ml y obtenemos otros 750 ml de
la comida.
·
Consumir todos los
días 1,5 litros de agua.
Deshidratación:
·
Provoca: dolor de
cabeza, cansancio y falta de concentración. (Lewis)
sábado, 14 de octubre de 2017
Conclusión
En enfermería conocer las soluciones acuosas nos sirven para poder realizar mezclas liquidas, como también conocer la concentración de disoluciones determinadas en cualquier medicamento, al aplicar soluciones conocer la cantidad de concentración líquido que se aplicara, al realizar las dietas para el paciente conocer las cantidades exactas, esto con la finalidad de tener una atención de calidad, ya que tenemos la vida de la persona en nuestras manos.
Bibliografía
Desconocido. (s.f.). Fundacion para la Formacion e
Investigacion Sanitarias de la Region de Murcia. Obtenido de
http://www.ffis.es/volviendoalobasico/1fisiologa_del_equilibrio_hdrico.html
Desconocido. (s.f.). h4hinitiative.com.
Obtenido de
http://www.h4hinitiative.com/es/hidratacion-diaria/regulacion-del-equilibrio-hidrico
Laawwr, D. (3 de
Diciembre de 2012). es.slideshare.net. Obtenido de
https://es.slideshare.net/diannalaww/soluciones-porcentuales
Lewis, J. L.
(s.f.). MANUAL MERCK. Obtenido de
http://www.merckmanuals.com/es-us/hogar/trastornos-hormonales-y-metab%C3%B3licos/equilibrio-h%C3%ADdrico/deshidrataci%C3%B3n
Lopez, J. (8 de Junio
de 2011). es.slideshare.net. Obtenido de
https://es.slideshare.net/jo01lopez234/soluciones-inyectables-y-soluciones-acuosas
Nieto, D. V. (26 de
Agosto de 2012). Medicopedia. Obtenido de
https://www.portalesmedicos.com/diccionario_medico/index.php/Osmolaridad
Suscribirse a:
Comentarios (Atom)